Ich habe letztens die erste Folge von Das Hausboot geschaut und irgendwie kam mir da schon der Gedanke, dass ich mal was zu Eisen- und Kalkablagerungen im Gehirn schreiben könnte. Weiß nicht, ob das jetzt mehr wegen Gunter Gabriel oder dem Hausboot an und für sich war. Und dann hatten wir prompt einen Patienten mit einem Morbus Fahr auf Station und deswegen geht jetzt um diese beiden Phänomene.
Aber auch nur so halb, denn was eigentlich viel interessanter ist, ist die Frage, welche Rolle Eisen bei neurodegenerativen Erkrankungen wie dem idiopathischen Parkinson-Syndrom oder der Alzheimer-Demenz spielt. Darum soll es auf jeden Fall auch gehen. Und damit fangen wir auch an. Die Literatur dazu ist allesamt so gute 5 Jahre alt, teilweise noch älter und ein wenig drängt sich der Eindruck auf, das ganze ist etwas aus dem Fokus geraten bei allen Versuchen Antikörper gegen Tau- oder ß-Amyloid- oder alpha-Synuclein-Ablagerungen zu finden.
Eisen und Neurodegeneration
Eisen-Physiologie im Gehirn im Laufe des Lebens
Der zerebrale Eisenstoffwechsel ist eine erstaunlich komplexe Kiste. Das Problem an Eisen ist, dass es für das Gehirn ziemlich unentbehrlich ist, da es sowohl in zwei- als auch dreiwertiger Form Elektronen abgeben kann und das in verschiedenen Stoffwechselvorgängen (z.B. der Atmungskette) gebraucht wird. Dieser Vorteil ist aber gleichzeitig auch das Hauptproblem, da Eisen über diese Elektronenabgabe freie Radikale bilden kann. Im Blut gelöstes Eisen kann selber nicht die Blut-Hirn-Schranke überwinden und benötigt daher ein spezielles Transportprotein namens transferrin receptor 1 (TfR1), welches von Neuronen gebildet wird. Es gibt Regulator-Proteine mit dem einfallsreichen Namen iron regulatory protein 1 und iron regulatory protein 2, sowie weitere Steuerungsproteine wie hypoxia inducible factor. Diese Steuerproteine sind wichtig, um den Eisenstoffwechsel in exakter Balance zu halten und eben nicht zu viel Radikalbildung zuzulassen.
Mit zunehmendem Lebensalter lässt sich (teilweise auch nur mikroskopisch) bei fast allen Individuen eine progrediente Eisenablagerung in den Stammganglien und der Substantia nigra beobachten. Der Grund hierfür ist unklar, ein Zusammenhang mit der im Alter ja zunehmend durchlässigen Blut-Hirn-Schranke wird aber diskutiert. Das ist in sofern ein Problem, da bei den jetzt folgenden Punkten eine große Schwierigkeit besteht, die Rolle der Eisenablagerungen richtig einzuschätzen, in wiefern sie einen normalen Alterungsprozess oder eine Pathologie darstellen.
Eisen bei neurodegenerativen Erkrankungen
Beim idiopathischen Parkinson-Syndrom scheint dreiwertiges Eisen die Akkumulation von alpha-Synuclein in den Lewy-Körperchen zu beschleunigen. Die alpha-Synuclein-Aggregate sind selber neuropathogen, da sie AMPA-Rezeptoren im großen Stil aktivieren und diese über den damit verbundenen Kalium-Einstrom auch neurotoxisch wirken, aber auch selbst als Aggregat neurotoxisch sind. Injiziert man Ratten Eisen in die Substantia nigra, entwickeln sie einen Ratten-Parkinson. In kleinen Fallserien wurden Eisenchelatbildner in der Therapie des idiopathischen Parkinson-Syndroms ausprobiert und haben neben einer Eisenabnahme auch zu einer Vermessung im UPDRS Teil III geführt.
Auch bei der Alzheimer-Demenz findet sich ein vermehrter Eisengehalt in den pathogenen Protein-Ablagerungen, v.a. in den ß-Amyloid-Plaques. Durch den Mangel an Tau-Protein scheint es einen Einfluss auf eine verminderte Aktivität auf die Eisen-Regulations-Proteine zu geben, mit der Folge, dass immer mehr Eisen akkumuliert. Bei Patienten mit einer leichten kognitiven Störung konnte gezeigt werden, dass ein erhöhter Liquor-Ferritin-Spiegel mit einer gute 9-Monate schnelleren Konversion zu einer Alzheimer-Demenz einherging und diese Patienten auch eine ausgeprägtere Hippocampus-Atrophie zeigten.
Ziemlich sicher ist eine aus der Grundlagenforschung abgeleitete Korrelation zwischen zunehmenden Eisenablagerungen und nachlassenden kognitiver Leistungsfähigkeit, sowie zwischen Eisenablagerungen und einer zunehmenden Feinmotorikstörung der Hände belegt.
Morbus Fahr und Neurodegeneration mit Eisenakkumulation im Gehirn
Neben diesen allgemeinen Beobachtungen bei neurodegenerativen Erkrankungen existieren zwei weitere Krankheitsbilder, um die es hier gehen soll. Der Morbus Fahr, bei dem es zu Kalziumablagerungen im Gehirn kommt und die Neurodegeneration mit Eisenakkumulation im Gehirn (nun ja, hier ist der Name Programm). Beides sind – in der symptomatischen Form – seltene bis sehr seltene Krankheitsbilder.
Morbus Fahr: Der erste Nazi und Kalziumablagerungen im (alternden) Gehirn
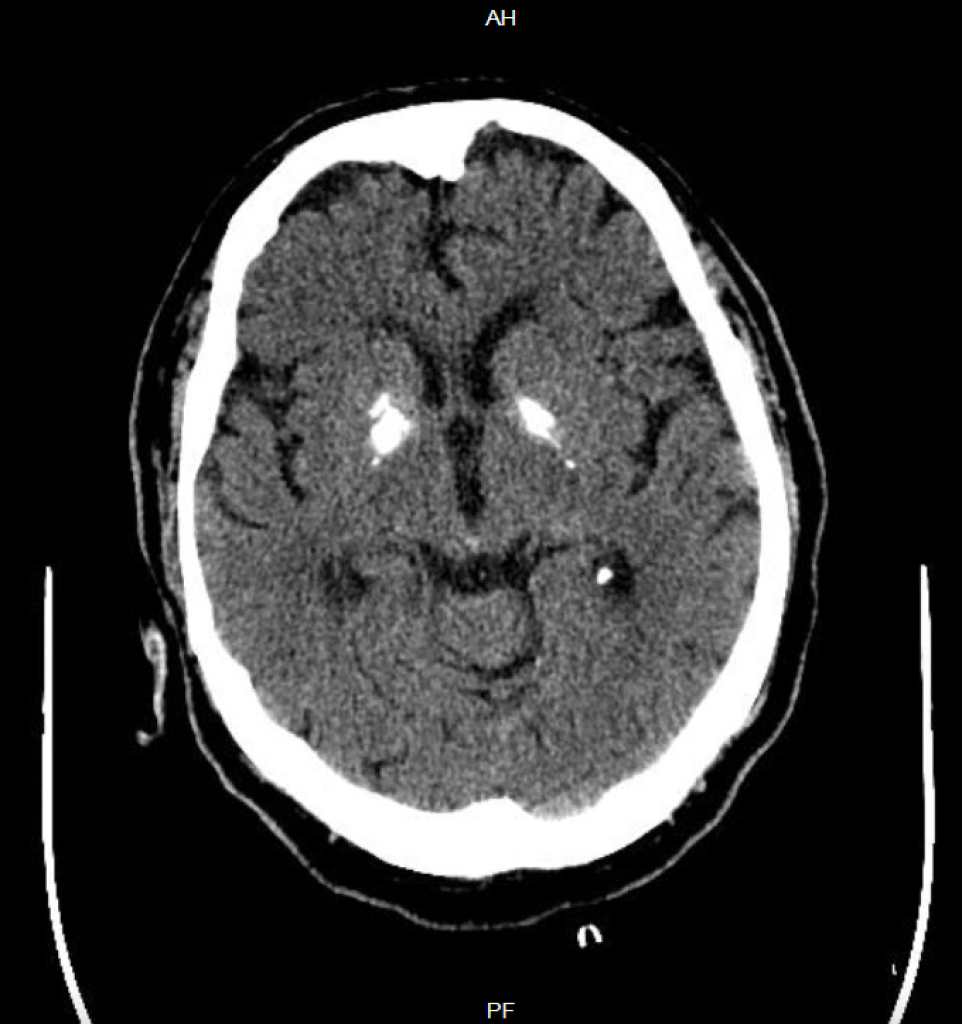
Häufiger als zu Eisen-, kommt es zu Kalziumablagerungen v.a. im Bereich der Stammganglien und des Kleinhirns. Es sind aber auch andere Manifestationsorte beschrieben, z.B. der Thalamus, das Marklager oder auch der Kortex. Diese Ablagerungen sind – in wenig bis mäßig ausgeprägtem Ausmaß – gar nicht selten (2-10% der Fälle in bildgebenden Reihenuntersuchungen) und häufig asymptomatisch. Symptomatische Formen sollen mit einer Häufigkeit von etwas über 1:1.000.000 auftreten. Theodor Fahr hat diese Krankheit 1930 erstmal beschrieben. Theodor Fahr ist von den drei deutschen Pathologen, um die es heute gehen soll und die alle in die Kategorie alte Nazis fallen, vermutlich noch der unproblematischste. Das ist wohl auch der Grund warum – anders als bei der Neurodegeneration mit Eisenakkumulation im Gehirn – noch der Eigenname für die Krankheit verwendet wird. Synonyme, die man aber auch ab und zu findet sind: Idiopathische Stammgabglienkalzifikation, striopallidodentale Kalzifikation.
Pathophysiologie
Aufgrund eines fehlerhaften Eisentransports und der Produktion freier Radikale (siehe oben, kennen wir ja schon) kommt es zu Gewebeschäden, die dann in einem zweiten Schritt zu den Kalzifikationen führen. Die Verkalkungen entwickeln sich zunächst innerhalb der Gefäßwand und in den perivaskulären Räumen und erstrecken sich später bis zu den Neuronen. Eine fortschreitende Mineralisierung der Basalganglien neigt dazu, das Gefäßlumen zu komprimieren, wodurch ein Teufelskreis aus gestörter Durchblutung, Verletzung des Nervengewebes und Mineralablagerung ausgelöst wird.
Den Morbus Fahr gibt es in verschiedenen Varianten:
- als autosomal-dominante Erkrankung
- als autosomal-rezessive Erkrankung
Dann gibt es noch ein sekundäres Fahr-Syndrom bei folgenden – in erster Linie endokrinologischen – Erkrankungen:
- Hypoparathyreoidismus
- Pseudohypoparathyreoidismus
- Hyperparathyreoidismus
- Vitamin D-Stoffwechselstörungen
- Bestimmte Mitochondriopathien (V.a. MELAS)
Bei der tuberösen Sklerose finden sich gehäuft Stammganglienverkalkungen, auch bei der Brucellose als Infektionskrankheit.
Klinik des Morbus Fahr
Die Klinik des Morbus Fahr richtet sich in erster Linie nach der Lokalisation der Verkalkungen und ihrem Ausmaß. So sind hypokinetisch-rigide, choreatiforme oder dystone Symptome durch die nahezu immer vorhandene Beteiligung der Stammganglien als häufigste klinische Manifestation beschrieben, aber auch Myoklonien oder spastische Paresen bei Einbeziehung der Pyramidenbahn.
Gehäuft kommt es zu einer symptomatischen Epilepsie und zu kognitiven Störungen. Nach einer Übersichtsarbeit (siehe unten) sind die Häufigkeiten von Bewegungsstörung bei einem Morbus Fahr in etwa wie folgt beschrieben: Bei 57% Parkinson-Syndrom, bei 19% Chorea, bei 8% Tremor, bei 8% Dystonie, bei 8% Atheose 5% und bei 3% der Patienten liegt eine orofaziale Dyskinesie vor.
Diagnosekriterien
Zur Abgrenzung von symptomatischen Formen hat man erstmals in den 1970er Jahren (mit Revisionen 1989 und 2005) Diagnosekriterien geschaffen, die wie folgt lauten:
- Bilaterale Verkalkung der Basalganglien in der Bildgebung. Andere Gehirnregionen können ebenfalls betroffen sein.
- Progressive neurologische Dysfunktionen, die im Allgemeinen eine Bewegungsstörung und / oder neuropsychiatrische Manifestationen umfassen. Das Erkrankungsalter liegt normalerweise im vierten oder fünften Jahrzehnt, obwohl die Symptome auch in der Kindheit auftreten können
- Fehlen biochemischer Anomalien und somatischer Merkmale, die auf eine mitochondriale oder metabolische Erkrankung oder eine andere systemische Störung hinweisen.
- Fehlen einer infektiösen, toxischen oder traumatischen Ursache.
- Familienanamnese im Einklang mit einer autosomal-dominanten Vererbung.
Diagnostik
Einfach ist der Morbus Fahr in der CT zu diagnostizieren, aber auch in der MRT kann man die Stammganglienkalzifizierungen mit einer Signalabsenkung in der T2 und hypo- aber auch hyperintensen T1-Veränderungen recht einfach feststellen.
Laborchemisch macht es Sinn eine Störung des Kalziumstoffwechsels zu überprüfen (Serum-Kalzium, Phosphat, Magnesium, Alkalische Phosphate, Calcitonin, PTH), ggfs. auch eine Schwermetallintoxikation zu erwägen. Zudem sollte eine diagnostische Liquorpunktion erfolgen, da es Kalzifikationen im Gehirn auch postinfektiös gibt.
Es gibt verschiedene Genloki, auf denen Mutationen vorkommen, die zu einem Morbus Fahr führen.
Behandlung
Eine kausale Therapie existiert nicht. Wenn eine endokrinologische Störung vorliegt, kann man wohl zumindest eine Progredienz durch die Behandlung der endokrinologischen Behandlung verhindern.
Die anderen beiden Nazis: Neurodegeneration mit Eisenakkumulation im Gehirn (neurodegeneration with brain iron accumulation, NBIA)
NBIA ist der Oberbegriff für verschiedene genetische Erkrankungen, die zu einer vermehrten Eisenakkumulation in den Stammganglien führen und darüber zu extrapyramidal-motorischen Symptomen. Teilweise finden sich auch noch andere Symptome, insbesondere zerebelläre Atrophien und früh einsetzende demenzielle Symptome. Teilweise sind schon Kinder- und Jungendliche betroffen. Auf Wikipedia findet sich eine recht umfangreiche Auflistung der gängigsten NBIA, die alle extrem selten sind, selbst in der Summe aller NBIA. Bei den allermeisten NBIA handelt es sich um autosomal-rezessiv vererbte Erkrankungen.
Pantothenatkinase-assoziierte Neurodegeneration
Die Pantothenatkinase-assoziierte Neurodegeneration ist noch die häufigste NBIA mit einer Prävalenz von 1-3/1.000.000 Einwohner. Und hier kommen die anderen beiden alten Nazis ins Spiel und zwar zwei wirklich schlimme: Julius Hallervorden und Hugo Spatz, beide waren unmittelbar an der Aktion T4 und auch der Kindereuthanasie beteiligt und haben im großen Stil Gehirne ermordeter Menschen mit Behinderung präpariert und untersucht. Die Pantothenatkinase-assoziierte Neurodegeneration war lange nach diesen beiden als Hallervorden-Spatz-Syndrom bekannt und diese Bezeichnung hält sich immer noch im Sprachgebrauch einzelner Neurologen und Radiologen.
Wo man weiterlesen kann:
Bei Orpha-Net: Morbus Fahr & NBIA
Saleem, S., Aslam, H., Anwar, M., Anwar, S., Saleem, M., Saleem, A., & Rehmani, M. A. (2013). Fahr’s syndrome: literature review of current evidence. Orphanet Journal of Rare Diseases, 8(1), 156. https://doi.org/10.1186/1750-1172-8-156
Schneider, S. A. (2016). Neurodegeneration with Brain Iron Accumulation. Current Neurology and Neuroscience Reports, 16(1), 9. https://doi.org/10.1007/s11910-015-0608-3
Küpper, C., Levin, J., & Klopstock, T. (2016). Eisen im alternden Gehirn. Aktuelle Neurologie, 43(01), 32–40. https://doi.org/10.1055/s-0035-1565121