Die Zahl der Notfallbehandlungen in Notaufnahmen nimmt in Deutschland – wie in anderen Ländern auch – seit Jahren kontinuierlich zu. Nach Angaben der Regierungskommission für eine moderne und bedarfsgerechte Krankenhausversorgung (Link) wurden 2009 noch 24,9 Millionen Notfallbehandlungen durchgeführt, 2019 waren es schon 27,8 Millionen Behandlungen in Notaufnahmen und Notfallpraxen, ein Plus von 12% innerhalb von 10 Jahren. Das merken wir im klinischen Alltag alle, jeden Tag. Eine Studie der Ludwig-Maximilians-Universität München kommt da gerade zur rechten Zeit und stößt in den sozialen Medien durchaus auf Resonanz:
Das LMU-Paper
Sitter, K., Braunstein, M. & Wörnle, M. Beweggründe von Patienten, die sich selbständig in der Notaufnahme vorstellen – eine prospektive monozentrische Beobachtungsstudie. Med Klin Intensivmed Notfmed (2024). https://doi.org/10.1007/s00063-024-01106-2
Die Arbeit von Sitter et al. untersuchte dabei prospektiv die Gründe, warum sich Menschen fußläufig mit internistischen Krankheitsbildern in der Notaufnahme vorstellten und das über einen Zeitraum von Mai 2018 bis August 2019. Die ZNA-Patienten wurden dabei mittels Fragebogen befragt, bei einer eher mäßigen Rücklaufquote von 18% der 6.122 Patienten, die zu Fuß die Notaufnahme erreichten. Der Anteil der „Fußgänger“ (51%) und der per Rettungsdienst vorgestellten Patienten (49%) war dabei nahezu gleich groß.
Auf Grund der zur Vorstellung in der Notaufnahme führenden Beschwerden hatte sich ein Großteil der Probanden in den letzten vier Wochen (62%) und in den letzten drei Monaten (31%) in ärztlicher Behandlung befunden. Spannend ist die Frage nach den Vorbehandlungen. Hier waren Mehrfachnennungen möglich.
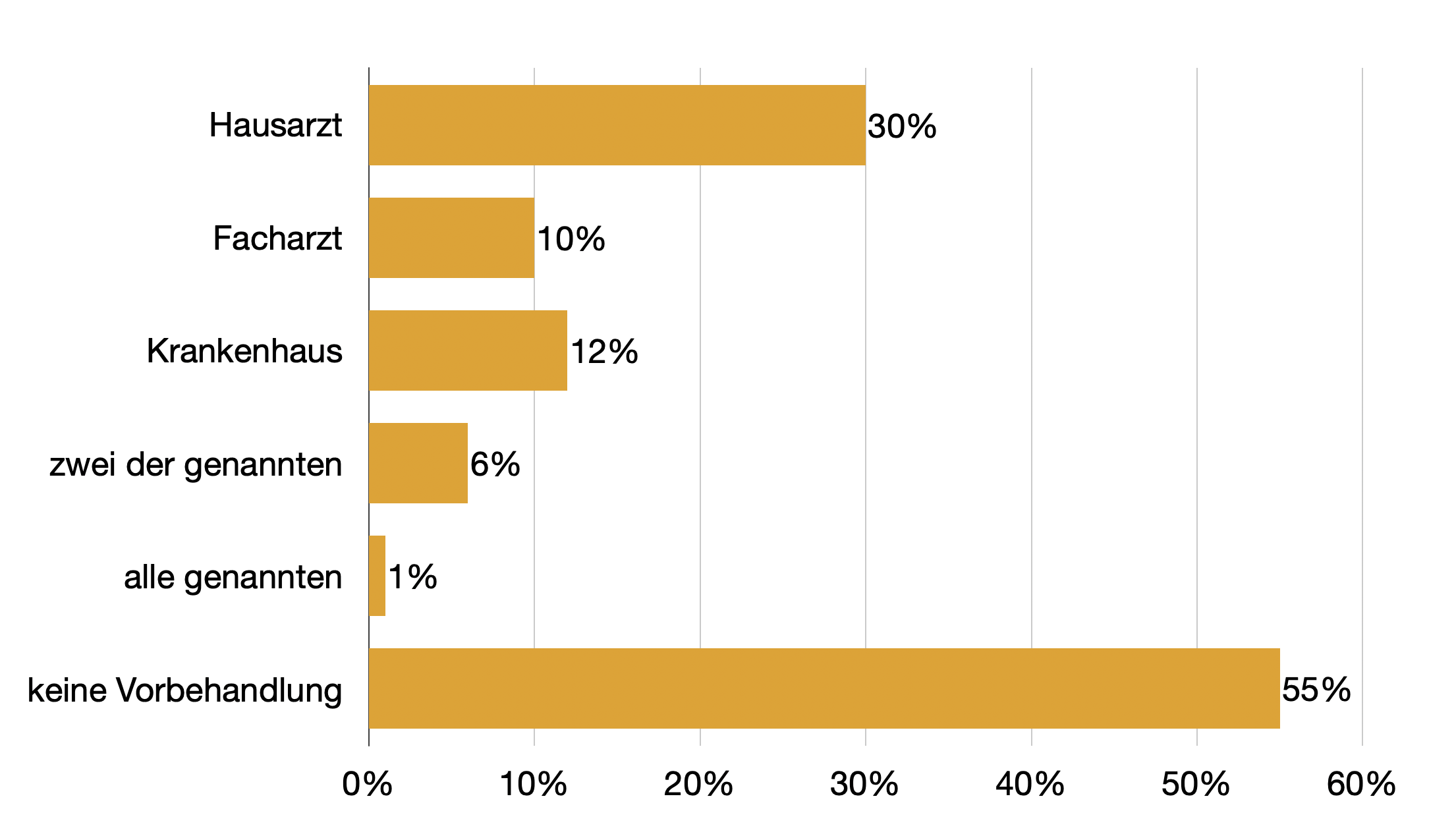
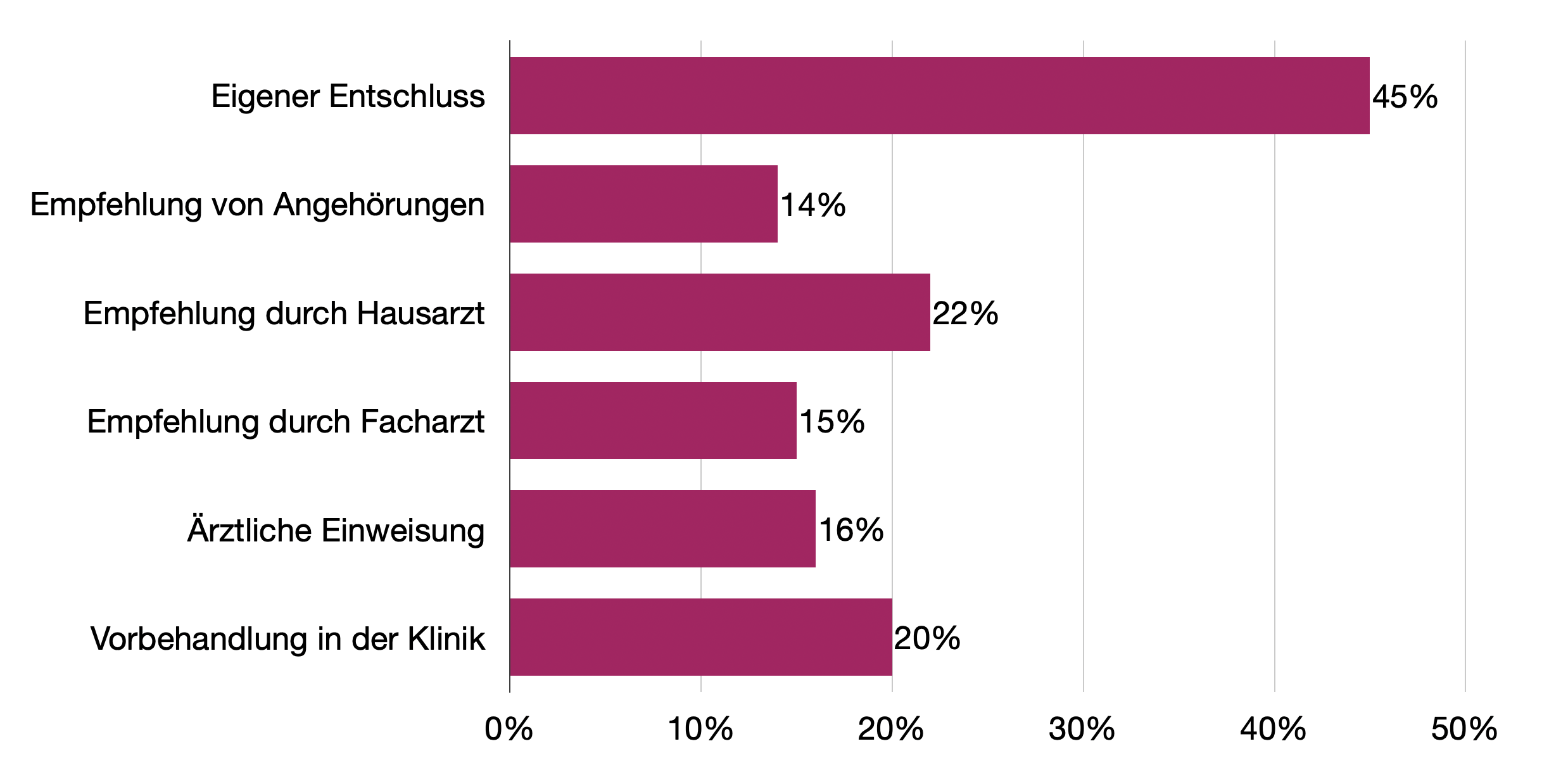
30% waren beim Hausarzt, 10% beim Facharzt gewesen. 45% der Patienten kamen auf eigenen Entschluss, 16% hatten eine Einweisung dabei, insgesamt 37% aber „nur“ eine ärztliche Empfehlung, sich im Krankenhaus vorzustellen. Bei der Aufschlüsselung nach Altersgruppen war der eigene Entschluss bei den jüngeren Patienten deutlich ausschlaggebender als bei den älteren. Dort waren es signifikant häufiger Vorverhandlungen in der Klinik und ärztliche Empfehlungen.
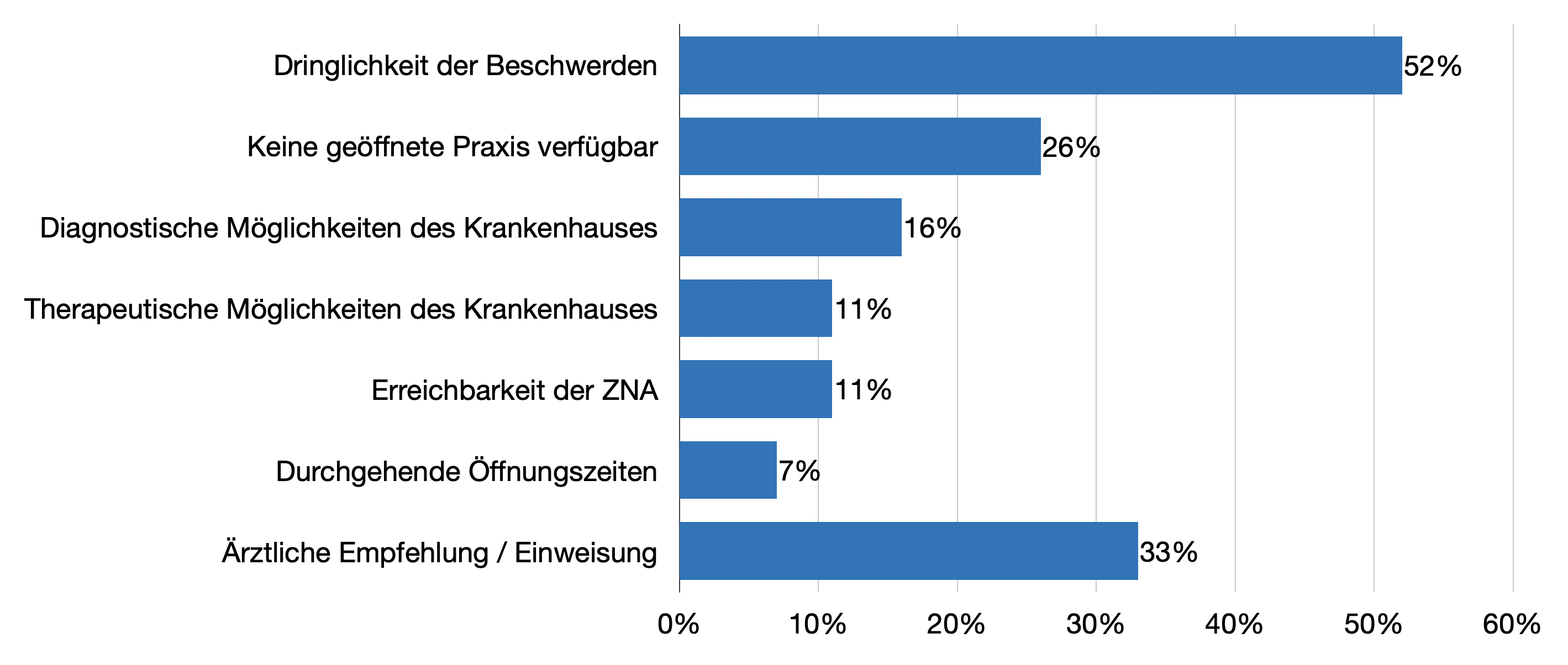
Hauptgründe für die Vorstellung in der ZNA statt in einer Praxis waren die empfundene Dringlichkeit der Beschwerden, die Vorstellung außerhalb von Praxisöffnungszeiten und in immerhin einem Drittel der Fälle eine ärztliche Einweisung oder Empfehlung.
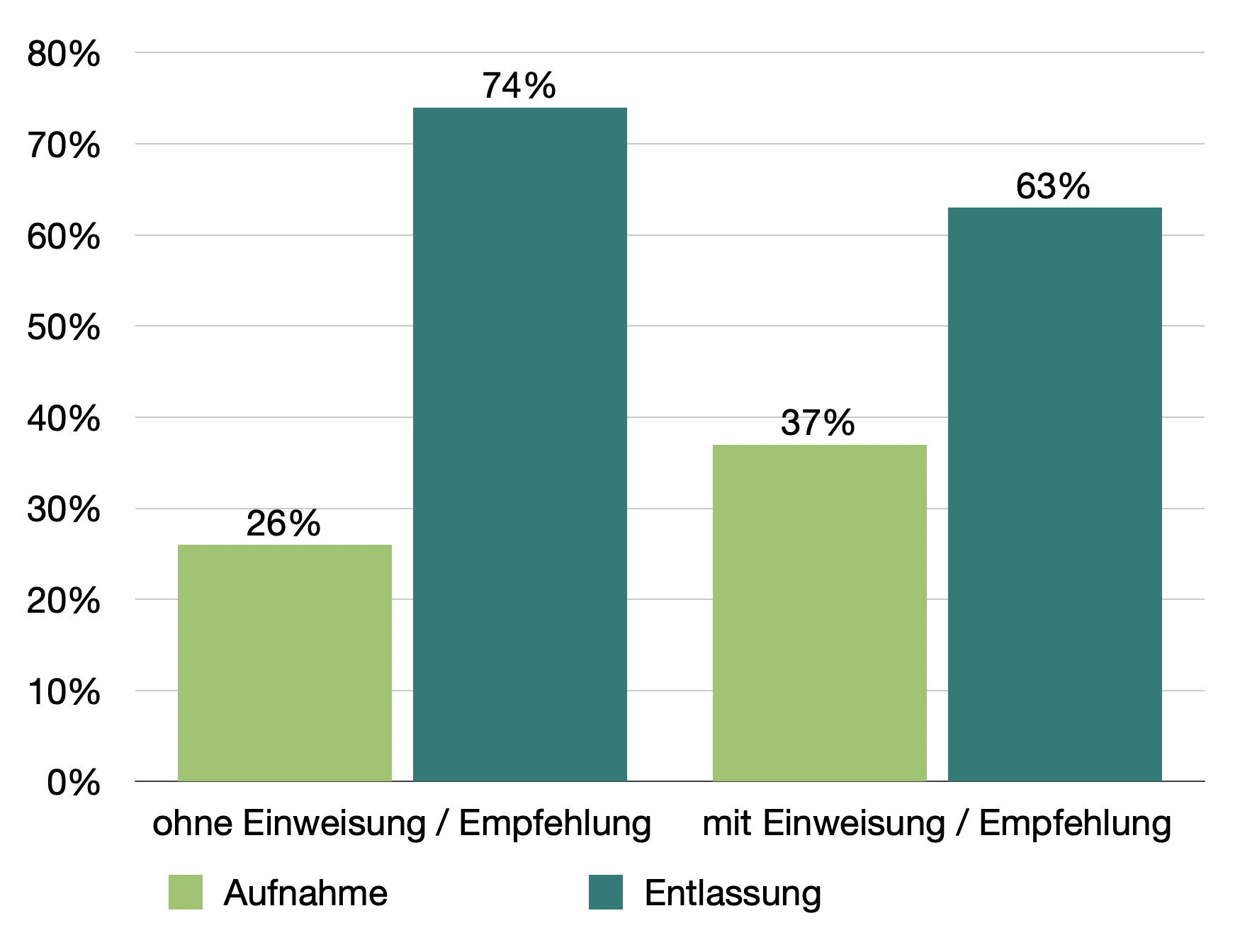
Von den Patienten, die sich fußläufig vorstellten konnten 68% wieder aus der ZNA entlassen werden, nur 28% mussten stationär aufgenommen. Der Unterschied bei den Patienten mit und ohne ärztliche Einweisung / Empfehlung war dabei nicht sehr groß, 26% der Patienten mit eigenem Entschluss zur Vorstellung und 37% der Patienten mit Einweisung oder ärztlicher Empfehlung wurden stationär aufgenommen.
Im Verlauf des Studienzeitraums wurde in der Notaufnahme ein Triage-System etabliert, der Emergency Severity Index, ein fünftstufiges Modell bei der 1 die höchste und 5 die niedrigste Behandlungsdringlichkeit anzeigt. Von den Studienteilnehmern nach Einführung des Triagesystems wurden 0% der höchsten Behandlungsdringlichkeit, 16% der Stufe 2, 57% der Stufe 3, 21,5% der Stufe 4 und 5% der Stufe 5 zugeordnet.
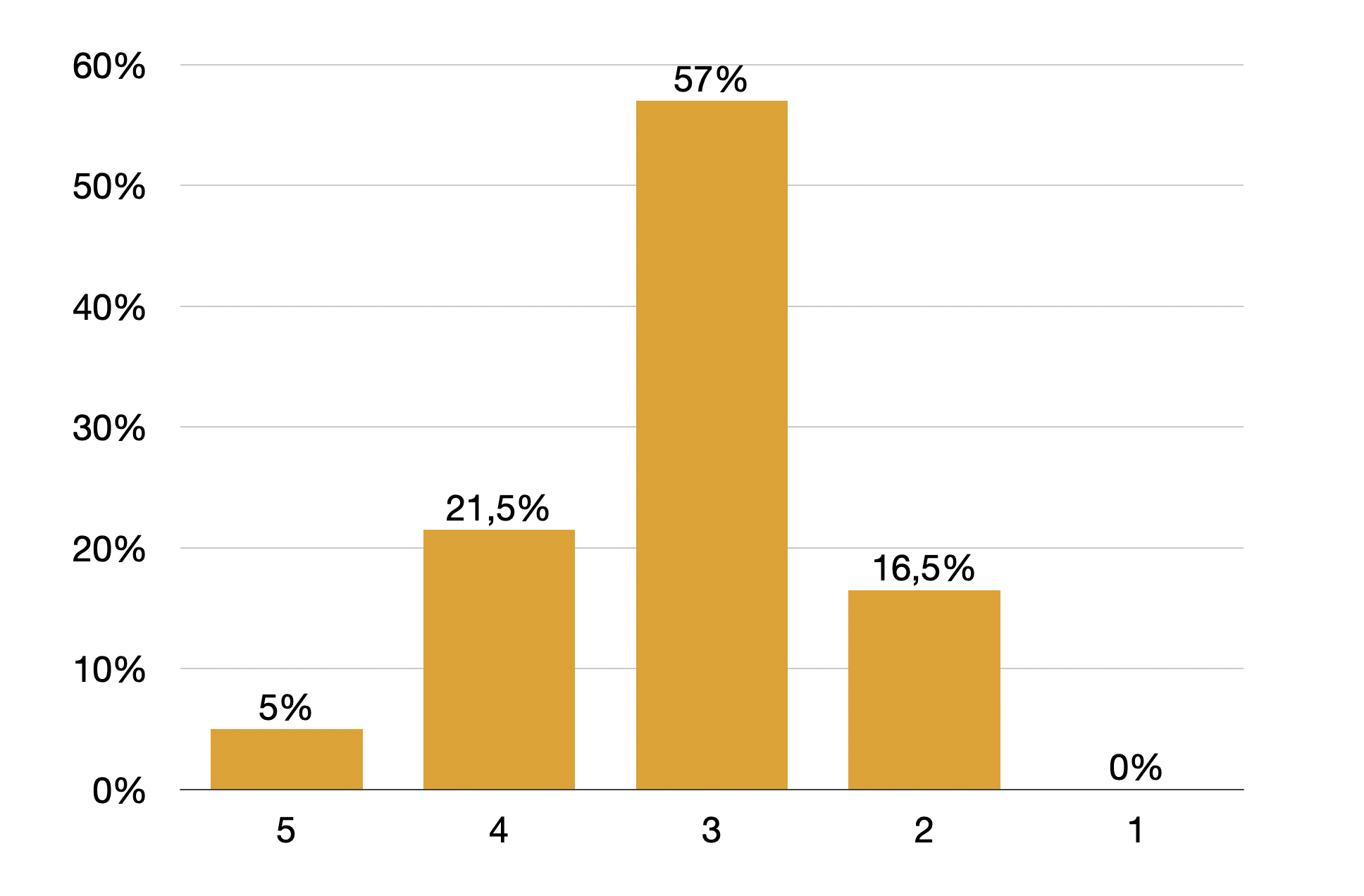
Interessant ist, dass die Selbsteinschätzung der Behandlungsdringlichkeit zwischen den Triagegruppen nicht stark divergierte, so schätzen 53% der Patienten mit der ESI-Stufe 5 ihre Beschwerden als sehr dringlich behandlungsbedürftig ein, bei den Patienten mit ESI-Stufe 2 waren es 44%.
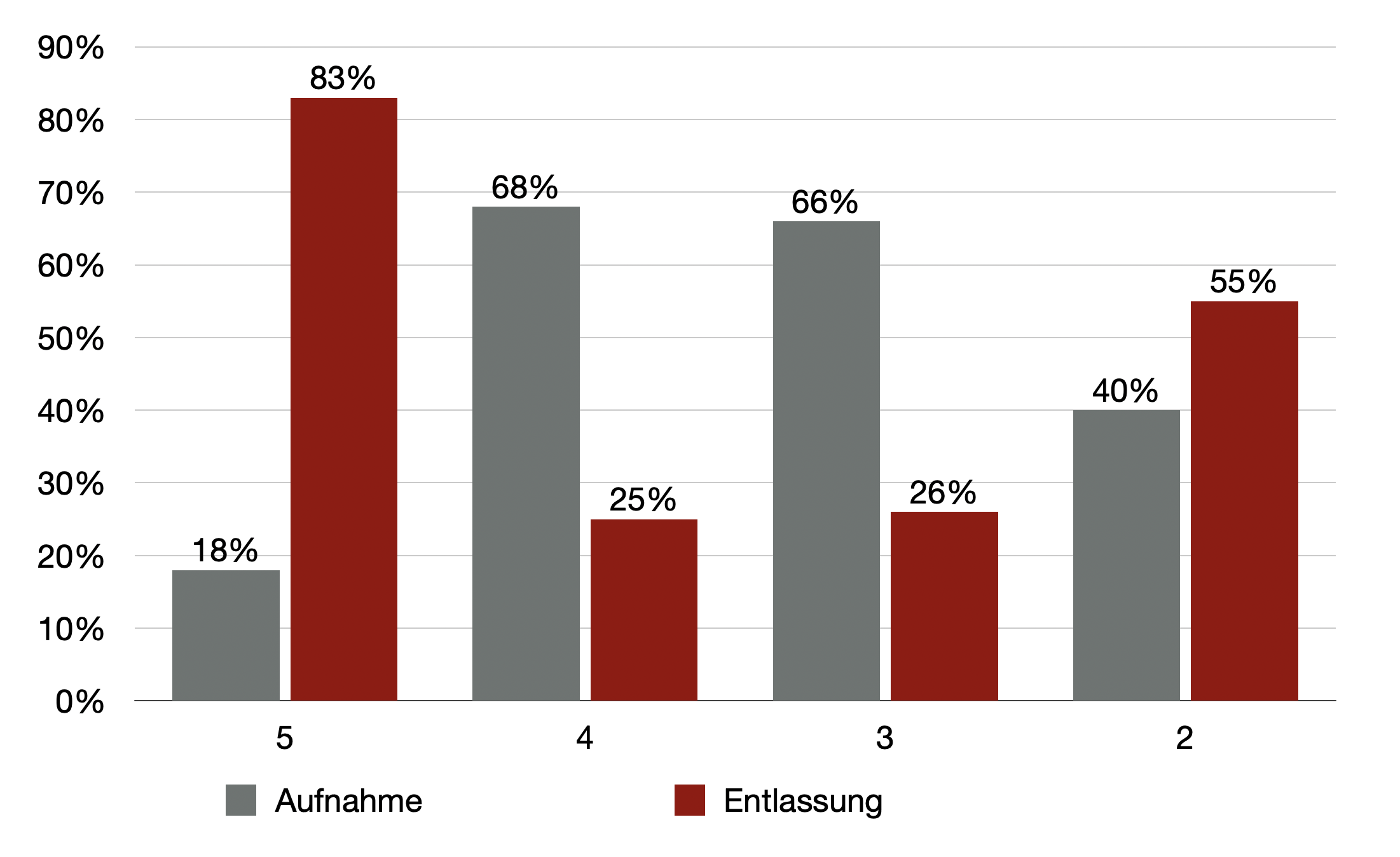
Von den Patienten mit der Triagekategorie 5 konnten 83% wieder entlassen werden, 18% wurden aufgenommen, in den Kategorien 3 und 4 waren es ca. zwei Drittel Entlassungen und in Kategorie 2 immerhin ebenfalls 55% Entlassungen und nur 40% Aufnahmen.
Das Barmer-Paper
Ganz aktuell wurde zudem eine Studie mit einer Analyse von 2 Millionen Krankenhausaufnahmen von Patienten, die bei der Barmer Ersatzkasse veröffentlicht. Hier geht es primär um die Nutzung von Rettungsmitteln für die Krankenhausaufnahme, es lassen sich aber auch einige interessante Punkte zum Thema fußläufige Selbsteinweisungen und -vorstellungen ableiten.
Roessler M, Schulte C, Bobeth C, Wende D, Karagiannidis C. Hospital admissions following emergency medical services in Germany: analysis of 2 million hospital cases in 2022. Med Klin Intensivmed Notfmed. Published online April 23, 2024. doi:10.1007/s00063-024-01148-6
28% der Barmer-Versicherten, die im Studienzeitraum 2022 stationär aufgenommen wurden nutzten hierfür Rettungsmittel, 72% der Krankenhausaufnahmen fanden aber damit per Selbstvorstellung – mit und ohne Einweisung – statt. Hier sind natürlich aber auch geplante elektive Aufnahmen mit eingeschlossen. Der Charme der Studie ist, dass die Barmer Ersatzkasse nach der Techniker Krankenkasse die zweitgrößte gesetzliche Krankenkasse (Link) ist und mit ca. 8,7 Millionen Versicherten wiederum einen 10% Anteil der deutschen Bevölkerung abbildet. Eingeschlossen wurden alle stationären und teilstationären Fälle mit einer Aufenthaltsdauer > 1 Tag, ausgeschlossen Aufnahmen die durch Verlegungen aus einem anderen Krankenhaus entstanden, um wirklich nur Primärbehandlungen abzubilden. Die Aufnahmen wurden in zwei Schweregrade (niedrig/mäßig und hoch) unterteilt.
Die Patienten, die ohne Rettungsdienst zur stationären Aufnahme kamen waren deutlich jünger als der Durchschnitt (78 Jahre), kamen im Vergleich zu denen per Rettungsdienst nur sehr selten aus Pflegeheimen (1,2% vs 10-20% je nach bodengebundenem Rettungsmittel), hatten überwiegend einen niedrigen oder mäßigen Schweregrad (51,4%), mussten hierdurch bedingt nur selten auf Intensivstationen behandelt, beatmet oder reanimiert werden und hatten somit natürlich auch eine deutlich geringere Krankenhaussterblichkeit (1% vs. ca. 10%). Sie machten einen überwiegenden Teil der sehr kurzen (< 1 Tag) und kurzen (< 3 Tage) stationären Behandlungen aus. Bei den Erkrankungen mit hohem Schweregrad bei den Patienten ohne Rettungsdienstnutzung waren es v.a. Arthrosen, die zur Aufnahme führten (vermutlich also Gelenkersatz-Operationen), psychiatrische und kardiologische Erkrankungen. Die häufigsten Fußgänger-Diagnosen bei den leichten und mäßigen Schweregraden machten Geburten, kardiologische Erkrankungen und viszeralchirurgische Eingriffe aus. Auffallend – und das betonten auch die Studienautoren – war, dass es sich v.a. bei den kardiologischen Diagnosen der Fußgänger-Patienten um Diagnosen handelte, die prinzipiell nicht zwingend krankenhauspflichtig erscheinen (Vorhofflimmern, Herzinsuffizienz, Hypertonie).
Einordnung der Studienergebnisse
Wie kann man die Studienergebnisse im Vergleich zu anderen Arbeiten einordnen? Die „Fußgänger“ waren insgesamt deutlich jünger als die durchschnittlichen Krankenhauspatienten in Deutschland ( Eckdaten der Krankenhauspatientinnen und -patienten, Statistisches Bundesamt),
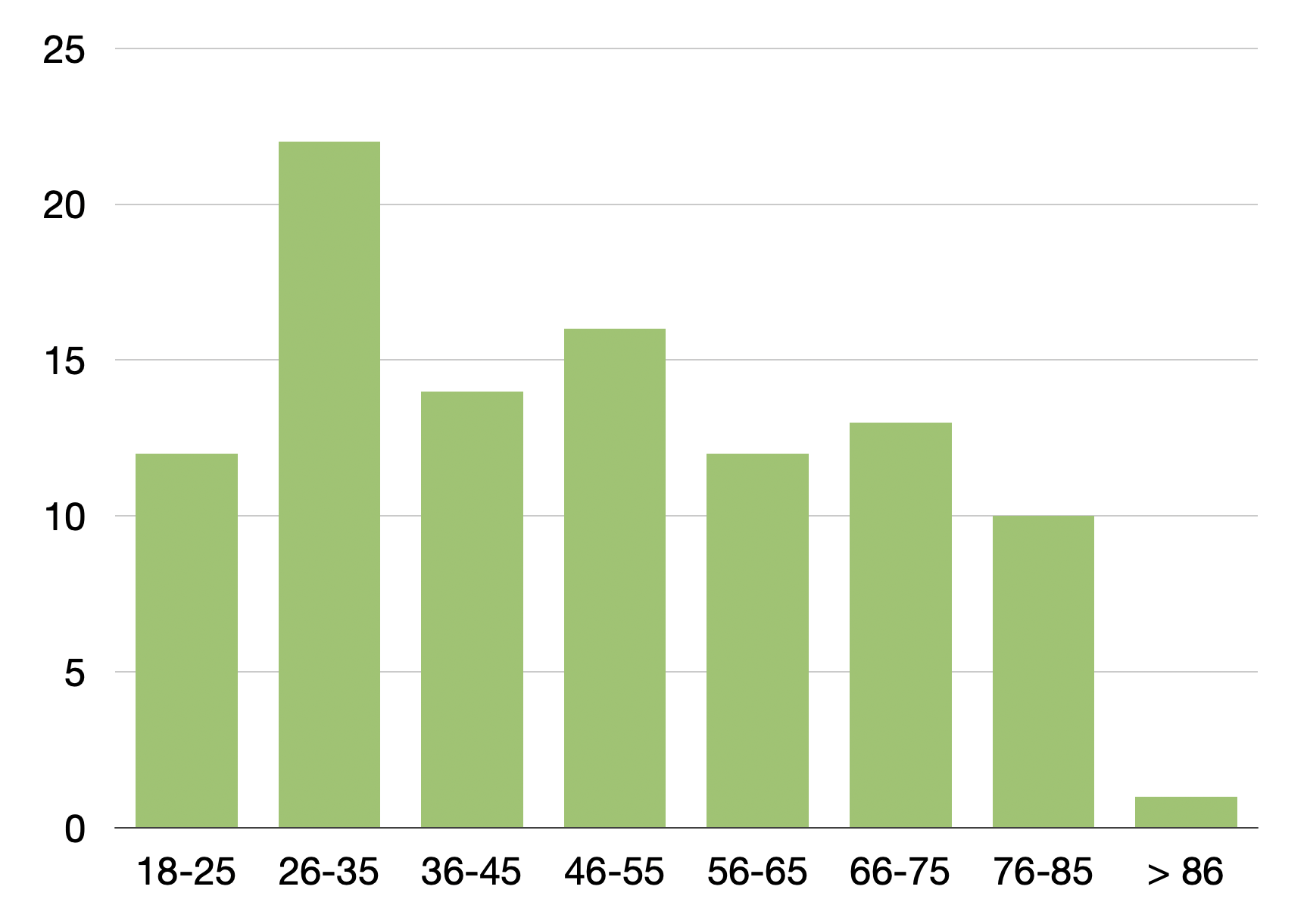
Die Altersverteilung in der Münchner Studie und auch der Fußgänger aus der Barmer-Studie ist aber vergleichbar mit anderen Studien zu fußläufigen Patienten, die in Notaufnahmen kommen (z.B. Seeger et al., Scheerer et al., Somasundaram et al.). Ebenfalls deckungsgleich war der eher höhere Bildungsstand der fußläufig die ZNA erreichenden Patienten (das wurde nur in der Münchner Studie untersucht). Hinsichtlich des Versicherungsstatus der eingeschlossenen Patienten scheint die Münchner Studie ein repräsentatives Bild abzugeben. In der Studie waren 86% der Teilnehmer gesetzlich versichert, 13% privatversichert und 1% hatte keine Krankenversicherung. Bundesweit sind 88% der versicherten Bevölkerung gesetzlich und 12% privat versichert (Krankenversicherungsschutz, Statistisches Bundesamt. Auch die Selbsteinschätzung der Patienten als eher dringliche Notfälle deckt sich mit anderen Arbeiten, auch aus anderen Fachrichtungen wie der Neurologie (Harenberg et al.). Zusammenfassend spricht viel dafür, dass die Ergebnisse der Münchner Studie für die Notfallversorgung in Deutschland repräsentativ sein dürfen.
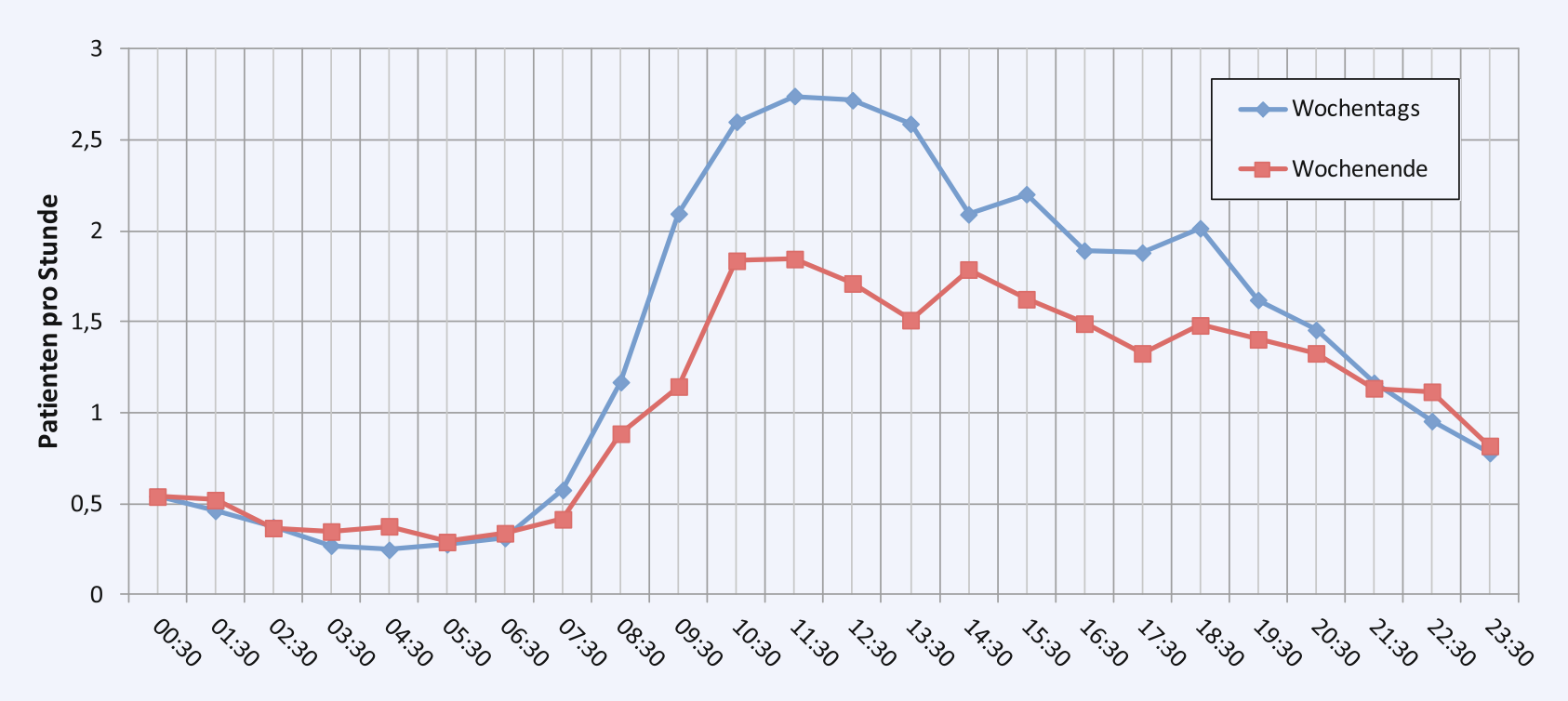
Aus anderen Studien, wie der Arbeit von Lange et al. weiß man, dass Patientenaufkommen – gerade durch die fußläufigen Patienten getrieben – erst in den späten Vormittagsstunden zunimmt und der Patientenzustrom bis zum späten Nachmittag/frühen Abend anhält, ebenfalls dass Montags traditionell die meisten Vorstellungen in den Notaufnahmen erfolgen.
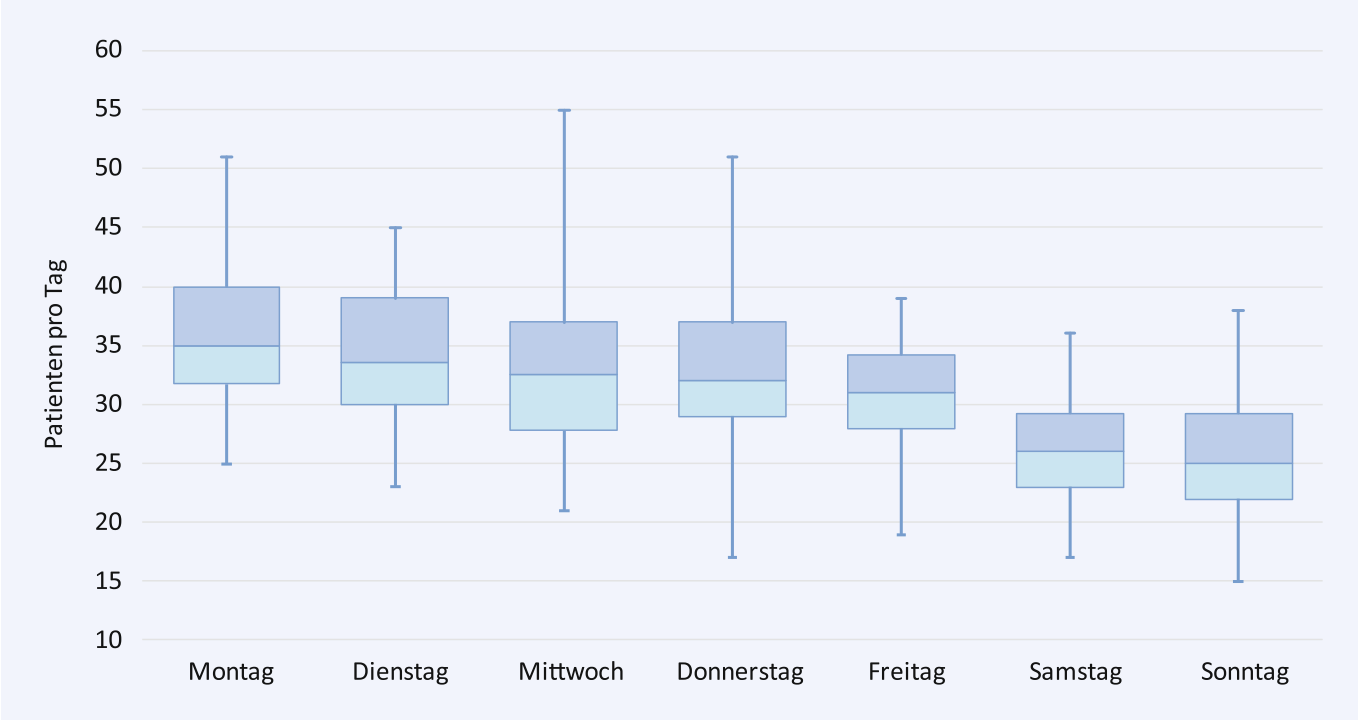
Als ein Hauptproblem in der stationären Notfallversorgung gilt der Patientenrückstau in der Notaufnahme, das sogenannte Crowding. Dies führt – gerade bei älteren und multimorbiden Patienten ( Roussel et al.) zu vermehrten Komplikation und einer deutlich erhöhten Mortalität. Als Hauptursache für das Crowding wurde lange der vermehrte Zustrom nicht dringlicher Patienten in die Notaufnahmen diskutiert, dies konnte in mehreren wissenschaftlichen Arbeiten aber so nicht bestätigt werden (z.B. Morley et al. und Kenny et al.). In aktuelleren Arbeiten werden typischerweise jeweils mehrere Faktoren in den Themenfeldern Input, Throughput und Output der Notaufnahmen adressiert, wobei nur beim Thema Input die Problemursache im wesentlichen außerhalb der Notaufnahme und des Krankenhauses liegt, ansonsten die wesentliche Faktoren aber in der Ablauforganisation in den Notaufnahmen und Bettenstationen begründet sind. Fußläufige, nicht dringliche Patienten gelten mittlerweile daher als ein Faktor im Themenfeld Input, wesentlicher das Crowding mitzuverursachen scheint aber der zunehmende Anteil von meist älteren Patienten mit komplexen und chronischen Erkrankungen zu sein, der zu einer Überforderung der Notaufnahmestrukturen führt.
Fazit
Die Münchner Studie zeigt, dass Simplifizierungen wie „wer zu Fuß in die Notaufnahme kommt, hat doch eh nichts“ und muss durch „Abschreckungsmaßnahmen“ wie Notfallgebühren usw. von der Vorstellung abgehalten werden zu kurz greifen. Auch ein zwingendes Primärarzt- und Zuweisungssystem (entweder zunächst hausärztliche oder fachärztliche Vorstellung oder Kontaktaufnahme mit dem kassenärztlichen Notdienst) reicht alleine nicht aus. Zum Einen wurde ein erheblicher Anteil der fußläufig die ZNA erreichenden Patienten in Triagekategorien mit höherer Dringlichkeit eingestuft, zum Anderen stellt sich ein erheblicher Teil mit ärztlicher Einweisung oder auf ärztliche Empfehlung vor. Einwenden kann man hier, dass sich höhere Triagekategorien in den gängigen Triagesystemen durch die Angabe von Schmerzen oder durch auffällige Vitalparameter ergeben und dass dies nicht zwingend mit der Notwendigkeit einer stationären Aufnahme korreliert, was man auch an den niedrigen Aufnahmeraten in der Münchner Studie und den kurzen Aufenthaltsdauern in der Barmer-Arbeit sieht. Bei den ärztlichen Einweisungen muss man zudem zwischen dem Anliegen von allgemeinärztlichen und fachärztlichen Zuweisungen unterscheiden. Erfahrungsgemäß (sicher nicht immer) sind hausärztliche Einweisungen eher durch fehlende ambulante fachärztliche Behandlungskapazitäten und/oder durch unterlagerte Versorgungsproblematiken begründet, fachärztliche Zuweisungen durch (tatsächlichen oder vermeintlichen) Bedarf „der besonderen Mittel des Krankenhauses“ wie es so schön in der Sozialgesetzgebung heißt. Zumindest für die Kardiologie (siehe Barmer-Studie) und für die Neurologie (meine anekdotische Evidenz) (und sicher auch für andere Disziplinen) bedeutet das, dass hier aber auch häufig Fälle dabei sind, bei denen es mehr der zeitliche Aufwand als der inhaltliche ist, der eine ambulante Versorgung nicht möglich, bzw. nicht finanziell auskömmlich möglich erscheinen lässt und zur Zuweisung führt.
Daraus resultieren verschiedene Verbesserungsmöglichkeiten:
Patienten mit einer ärztlichen, gerade mit einer fachärztlichen, Einweisung/Behandlungsempfehlung sind in einer Notaufnahme inhaltlich in der Regel falsch aufgehoben. Notaufnahmen sind strukturell auf die Versorgung akut bis kritisch kranker, immobiler Patienten ausgerichtet. Fachärztliche Expertise (außer notfallmedizinische) ist hingegen eher rar gesät, Vordergrunddienste in Notaufnahmen werden in der Regel von Ärzten in Weiterbildung zum Facharzt besetzt. Patienten, die mit einer konkreten (und teilweise hochspezialisierten und komplexen) Fragestellung zugewiesen werden, brauchen in der Regel fachärztlichen Rat und Behandlung. Das derzeitige Vorgehen führt dazu, dass diese Patienten zum Einen sehr lange in der Notaufnahme warten, dann inhaltlich schlechter als eigentlich möglich behandelt werden, ggfs. aus Verlegenheit oder weil es organisatorisch nicht anders zu realisieren ist aufgenommen werden und dann rasch wieder entlassen werden oder die ZNA nach vielen Stunden (häufig > 12) wieder verlassen.
Eine Zuweisungssteuerung z.B. mittels medizinischer Messenger-Dienste, die unkompliziert Zuweiser-Netzwerk-Bildung und Kontaktaufnahme der verschiedenen Akteure miteinander ermöglichen in Kombination mit einem Ausbau der vielerorts vorhandenen prästationären Sprechstunden könnte hier Abhilfe schaffen. Dann könnten derartige Patienten „auf kurzem Dienstweg“ besprochen werden und dann zielgerichtet im Krankenhaus fachärztlich gesehen werden. Dies wäre ein Punkt, der keine weitere gesundheits- und ordnungspolitische Vorarbeit benötigen würde, sondern mit den vorhandenen Mitteln regional sofort umgesetzt werden könnte, wenn denn genug Eigeninitiative bei den lokalen Akteuren besteht.
Der Elefant im Raum – und das adressiert ja auch die Barmer-Arbeit – ist dabei sicherlich das Nebeneinander ambulant und stationär behandelnder Fachärzte mit strenger Trennung der Sektoren, die erst überhaupt das Phänomen der fachärztlichen Einweisung möglich macht. Eine Änderung hier ist – ohne z.B. demographisch begründete Not, so dass ohne Verschmelzung der Sektoren die Versorgung nicht gewährleistet werden kann – berufs- und gesundheitspolitisch derzeit aber absolut unrealistisch.
Für Patienten, die sich auf Grund von Eigenmotivation in der Notaufnahme vorstellen erscheint die im Vorschlag der Regierungskommission vorgesehene Steuerung über eine verpflichtende Konsultation der Notrufnummer 116 117, deren Kompetenzen aber ausgebaut werden müssen hingegen sehr sinnvoll.
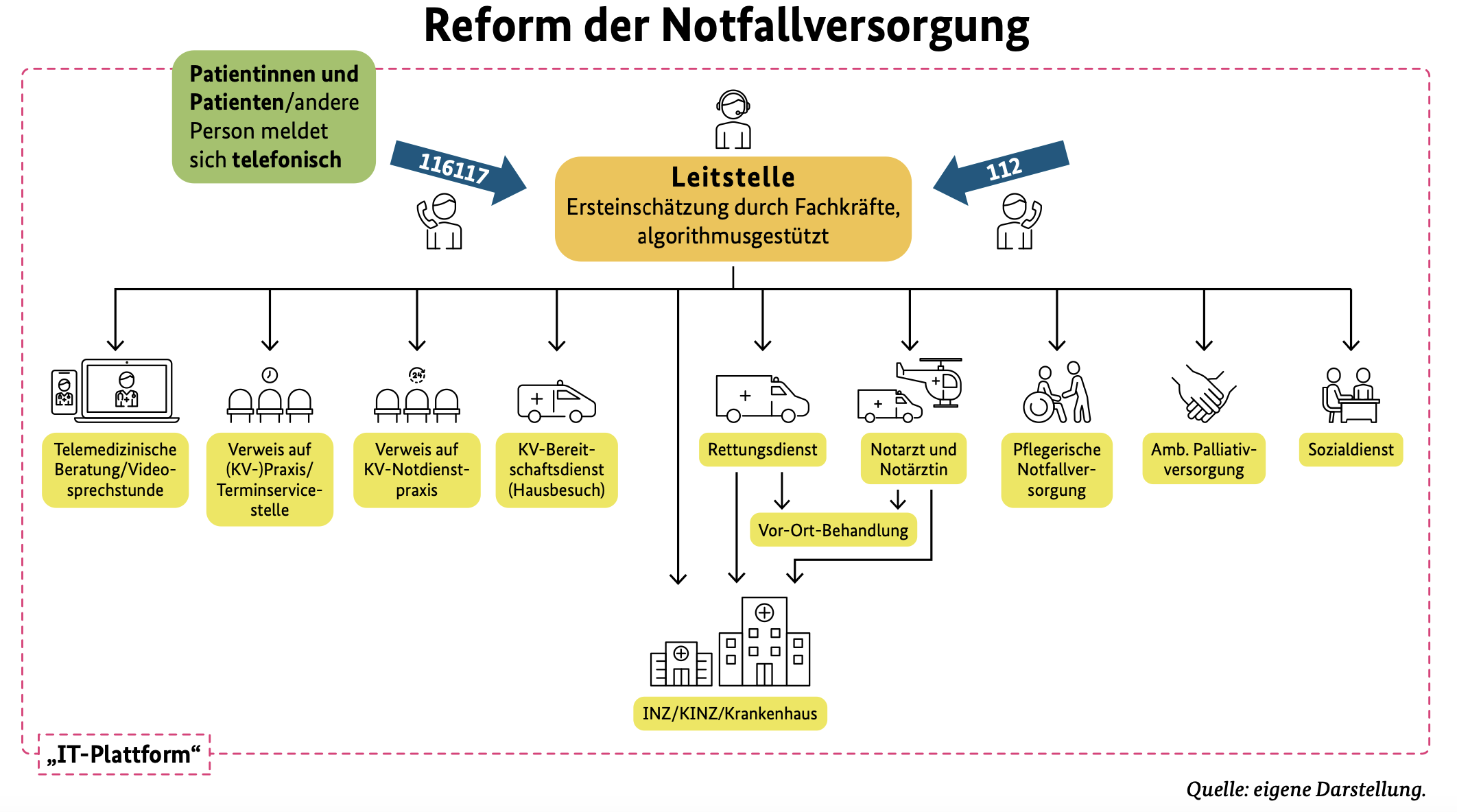
Hiernach wäre es möglich, dass die neuen integrierten Leitstellen ein differenziertes Angebot von telemedizinischer Beratung über Terminvermittlung bei niedergelassenen Ätzten, Verweis auf Notfallpraxen, Aktivierung des KV-Bereitschaftsdienstes für einen Hausbesuch, ambulanter pflegerischer Versorgung, Aktivierung eines Sozialdienstes bei Versorgungsproblemen oder eines palliativen Pflegedienstes bei entsprechender Behandlungsindikation bis hin zum Stellen der Indikation für ein Aufsuchen der Notaufnahme anbieten. Auch hier dürfte mit der Nutzung von Messenger-Diensten eine inhaltlich bessere Steuerung der Patienten und Absprache möglich werden.
Wo man weiterlesen kann
Roessler M, Schulte C, Bobeth C, Wende D, Karagiannidis C. Hospital admissions following emergency medical services in Germany: analysis of 2 million hospital cases in 2022. Med Klin Intensivmed Notfmed. Published online April 23, 2024. doi:10.1007/s00063-024-01148-6
Sitter, K., Braunstein, M. & Wörnle, M. Beweggründe von Patienten, die sich selbständig in der Notaufnahme vorstellen – eine prospektive monozentrische Beobachtungsstudie. Med Klin Intensivmed Notfmed (2024). https://doi.org/10.1007/s00063-024-01106-2
Vierte Stellungnahme und Empfehlung der Regierungskommission für eine moderne und bedarfsgerechte Krankenhausversorgung Reform der Notfall- und Akutversorgung in Deutschland. Integrierte Notfallzentren und Integrierte Leitstellen. Link.
Weitere Literatur
Harenberg, L., Oßwald, H. M., Jaschonek, H., & Nagel, S. (2019). Selbsteinschätzung der Behandlungsdringlichkeit bei Vorstellung in einer neurologischen Notfallambulanz. Der Nervenarzt, 90(2), 175–182. https://doi.org/10.1007/s00115-018-0623-0
Kenny JF, Chang BC, Hemmert KC. Factors Affecting Emergency Department Crowding. Emergency Medicine Clinics of North America. 2020;38(3):573-587. doi:10.1016/j.emc.2020.04.001
Lange, R., Popp, S., & Erbguth, F. (2016). Brennpunkt Notaufnahme. Der Nervenarzt, 87(6), 592–602. https://doi.org/10.1007/s00115-016-0116-y
Morley C, Unwin M, Peterson GM, Stankovich J, Kinsman L. Emergency department crowding: A systematic review of causes, consequences and solutions. Bellolio F, ed. PLoS ONE. 2018;13(8):e0203316. doi:10.1371/journal.pone.0203316
Pérez de la Ossa N, Abilleira S, Jovin TG, et al. Effect of Direct Transportation to Thrombectomy-Capable Center vs Local Stroke Center on Neurological Outcomes in Patients With Suspected Large-Vessel Occlusion Stroke in Nonurban Areas: The RACECAT Randomized Clinical Trial. JAMA. 2022;327(18):1782–1794. doi:10.1001/jama.2022.4404
Roussel M, Teissandier D, Yordanov Y, et al. Overnight Stay in the Emergency Department and Mortality in Older Patients. JAMA Intern Med. 2023;183(12):1378-1385. doi:10.1001/jamainternmed.2023.5961
Seeger, I., Thate, S., Ansmann, L. et al. Inanspruchnahme der Notfallversorgung im Nordwesten Deutschlands. Notfall Rettungsmed (2022). https://doi.org/10.1007/s10049-022-01083-z
Scherer M, Lühmann D, Kazek A, Hansen H, Schäfer I. Patients Attending Emergency Departments. Deutsches Ärzteblatt international. Published online September 29, 2017. doi:10.3238/arztebl.2017.0645
Somasundaram R, Geissler A, Leidel BA, Wrede CE. Beweggründe für die Inanspruchnahme von Notaufnahmen – Ergebnisse einer Patientenbefragung Reasons for Emergency Department Visits: Results of a Patient Survey. Gesundheitswesen. 2018;80(7):621-627. doi:10.1055/s-0042-112459
Fotoquelle
Foto von Mufid Majnun auf Unsplash